新闻中心讯 近年来临床研究发现,糖尿病患者患癌症的比率已明显高于非糖尿病患者,而治疗糖尿病的药物二甲双胍也在降低癌症风险上展现出优良成效。在糖尿病和癌症这两种疾病之间,是否存在着某种仍未被科学研究发现的联系?为何防治糖尿病的药物二甲双胍也能够在预防癌症的舞台上大显身手?
北京时间7月19日凌晨,《自然》(Nature)杂志在线发表了复旦大学生物医学研究院施扬/石雨江教授团队的重大科研成果。这篇以《葡萄糖通过AMPK介导的对TET2蛋白的磷酸化调控揭示了糖尿病与癌症内在关联的新通路》(“Glucose-regulated phosphorylation of TET2 by AMPK
reveals a pathway linking diabetes to cancer”)为题的论文,对以上问题作出了解答。
该课题由复旦大学、复旦大学附属中山医院及哈佛布雷根医院合作完成。复旦大学分时特聘教授、哈佛大学副教授石雨江为论文通讯作者;康奈尔大学在读博士、哈佛大学研究员吴镝和复旦大学-哈佛大学联合培养博士胡笛承担了大部分工作,与复旦大学博士、哈佛大学医学院博士后陈浩,以及复旦大学附属中山医院肝脏外科主任医师、哈佛大学高级访问学者施国明为共同第一作者;此外,复旦大学分时特聘教授施扬、附属中山医院院长樊嘉及生物医学研究院执行院长徐国良也对课题给予了大力支持和指导。
发现新通路:糖尿病患者为何更易患癌症?
直至今日,癌症依然是令人谈之色变的疾病。学者们前赴后继地投入到与癌症相关的研究中,而真正行之有效的应对办法始终难以满足人类对健康越来越突出的需求。究其根源,导致癌症的原因有许多。除了为众人所熟知的DNA序列突变与基因遗传,还有许多来自于基因密码之外的因素。如水、空气、营养等环境因素都可能在特定情况下,对人体遗传性状进行调控,使得一部分健康的基因组产生非正常表达,甚至是“失语”。当身体内原本坚固的抗癌防线逐步失去效用,患癌症的风险自然也就增高了。以上正是表观遗传学的研究基础。以此为视角重新审视致癌背后的原因,为石雨江团队最终发现糖尿病与癌症之间的新通路,提供了理论依据。
那么,营养环境是如何影响癌症的产生呢?
TET2蛋白催化DNA上5mC向5hmC修饰的转化。 在癌细胞里5hmC水平出现广泛的下降,可作为衡量癌症恶性程度的标志(cancer hallmark)。石雨江团队在实验中发现,高血糖水平会显著抑制身体内AMPK蛋白激酶的活性,导致TET2Ser99磷酸化与TET2蛋白稳定性降低,以减少TET2蛋白催化生成5-hmC。当5hmC减少,意味着肿瘤发生的可能性也随之增大。简言之,这一新通路就好比一根链条,糖尿病患者体内的高血糖水平正是链条的一个端口。在环环相扣的连锁反应之下,高糖环境最终会破坏5-hmC表观抑癌修饰的生成。表观抑癌修饰变少了,患病风险自然大大提高。
石雨江团队的创新成果为糖尿病与癌症之间的关系找到了一条不同于以往代谢视角的新通路。研究不仅揭示了糖尿病与癌症之间确实存在着传导通路,还指出部分糖尿病治疗药物也能有效地降低部分癌症爆发的风险。该项研究对于理解糖尿病与肿瘤发生的关系具有重要意义,为肿瘤防治研究提供了全新的思路与可能。
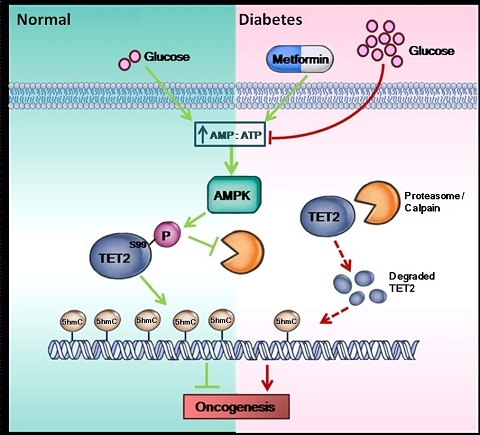
图一揭示了一条新的糖尿病高血糖和癌症内在关联的表观遗传通路并阐述了新的二甲双胍在抑制肿瘤中的表观遗传作用机理。
发现新思路:为预防癌症的药物研发提供新可能
既然糖尿病与癌症之间确实存在着传导通路,那么治疗糖尿病的相关药物是否也同样对预防癌症有一定帮助呢?
为了验证猜想,石雨江团队以糖尿病治疗药物二甲双胍为例进行了实验。研究发现,二甲双胍通过激活AMPK,磷酸化下游的TET2,增强TET2稳定性和其产物5hmC, 来对肿瘤生长达到抑制。并且二甲双胍的抑制作用要明显依赖于TET2的存在。虽然二甲双胍多年广泛应用于临床,其它的作用机制却一直不明确,该发现是首次报道AMPK与TET2相互作用,将能量调控和表观遗传关键酶直接联系在一起,并且揭示能量调控要依赖于表观遗传调控。
以此为例,药物是否能有效预防部分癌症的关键不在于血糖浓度的高低,而在于能否真正激活AMPK蛋白激酶以稳定TET2蛋白增加5hmC水平,以保证人体细胞的后续工作正常运行。通过服用糖尿病相关药物以降低血糖浓度,确实能在一定程度上同时降低高血糖水平对AMPK蛋白激酶的抑制程度,但这并不意味着蛋白激酶就能由此重新焕发“活力”。但是少摄入糖分,保持体内血糖始终维持在较低水平,减少对AMPK蛋白激酶的抑制频率,提高TET2蛋白的稳定性,升高5hmC水平,对防治部分肿瘤依然有着积极作用。此项研究也将为更多临床研究和预防癌症的药物开发奠定基础。
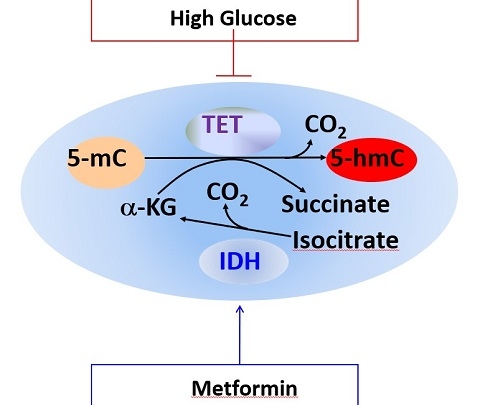
图二模型表明DNA去甲基化酶及抑癌基因TET2是如何在营养相关的代谢酶和代谢中间产物的参与下调控细胞DNA甲基化及羟甲基化的状态的并揭示了高糖和二甲双胍对此机制的影响。
石雨江:科研是一步步点亮未知的地图
谈及研究缘起,石雨江表示其实这整个项目都诞生于一次意外且偶然的尝试。
TET2蛋白作为表观遗传领域里的新星,其调控机制一直是研究热点。2010年春天,复旦大学2008级博士生胡笛来到石雨江位于哈佛大学的实验室,参与两校联培。2011年夏天她接手了OGT(葡萄糖胺转移酶)和TET2相互调控的课题。起初的猜想是OGT通过糖基化并切割TET2来影响TET2稳定性。遗憾的是,在接下来的半年时间里,胡笛的实验始终进展不顺。经过一段时间的尝试后,她不得不从源头来寻找可能性。或许使用葡萄糖作为调控因子,直接检验葡萄糖浓度是否会对TET2产物5-hmC产生影响,能为实验带来转机呢?在石雨江和同伴吴镝的建议下,胡笛重新更改了实验方法。令人惊讶的是,在低糖条件下培养的细胞5-hmC竟然出现了显著升高。葡萄糖和TET2蛋白之间确实存在着紧密的联系。
正当实验开始朝着崭新的方向发展时,有关OGT和TET2蛋白调控机制的文章陆续刊登在了各大期刊中。同行学者们的实验结果,一次次导向并验证了OGT对TET2蛋白的稳定性并不造成调控与影响。这恰恰与课题组的猜想背道而驰,实验再次陷入了被“双杀”的境地。
既然葡萄糖不是通过OGT来对TET2进行调控从而影响5-hmC,那么实验结果又是因何而来呢?带着疑惑,吴镝再次回顾了过往的实验数据,一个看似不相关的结果首次跳入了他的脑海。“或许,葡萄糖是通过磷酸化TET2来实现调控的。”
正是这一猜想,将研究成功引向了最终的航道。而本是计算生物学背景出身的吴镝当时正在哈佛的另一个实验室工作。作为项目的共同开拓者,在初始的一段时期里,吴镝利用每天晚上下班后,和次日早晨上班前的这段休息时间,泡在实验室里进行实验。半夜离开,凌晨归来,吴镝的付出最终为后续解决关键性问题打下基础。不久后吴镝正式加入了石雨江团队。
2012年春天,胡笛在哈佛的联合培养业已结束。带着刚刚步入正轨却前途未卜的课题,胡笛回到了复旦实验室。每日只能通过电话,和仍在美国的吴镝沟通实验进展。与此同时,经过反复查找,石雨江终于在一个叫作“AMPK”的激酶上找到了希望。而石雨江的另一位博士生陈浩也为实验添上了重要的一环。所有的元素终于被串联起来: 低糖可以激活AMPK,后者可以磷酸化TET2,从而影响到最下游的5hmC。胡笛马上着手动物学实验,结果出人意料得好。
再次回首整个研究,石雨江表示,自己和团队所做的不过是为这一领域的研究打开一扇全新的窗户,后续完善与临床应用仍有待不断探索。“我们做科研就像是许多学者共同绘制一幅画作,一步步点亮科学未知的地图。有人为画作添上鼻子,有人画一双眼睛。我们每个人所做的其实都只是这幅画作中极其微小的一部分。但是当这些微小的拼图一块块连接在一起时,科学的图纸就会变得越来越宽阔。”
(封面制图:陈文雪)